Фон
Паркинсонизм, вызванный лекарственными препаратами (DIP), имеет высокую распространенность и связан с ухудшением качества жизни. Чтобы найти практический клинический инструмент для оценки DIP у пациентов с тяжелыми психическими заболеваниями (SMI), была оценена связь между частотой мигания и лекарственным паркинсонизмом (DIP).
методы
В когорте из 204 пациентов со SMI, получающих лечение в единственной психиатрической службе предыдущих Нидерландских Антильских островов, частота морганий в минуту во время разговора была оценена дополнительным обученным специалистом по расстройствам движения. DIP был оценен по единой шкале оценки болезни Паркинсона (UPDRS) в 878 оценках в течение 18 лет. Диагностические значения частоты моргания были рассчитаны.
Результаты
Распространенность DIP составила 36%, средняя частота морганий составила 14 (стандартное отклонение (SD) 11) для пациентов с DIP и 19 (SD 14) для пациентов без. Была отмечена значительная связь между частотой мигания и DIP (р <0, 001). При частоте мигания 20 миганий в минуту чувствительность составила 77%, а специфичность - 38%. Модель отсечения 10% -ного процентиля привела к площади под кривой ROC 0, 61. Модель логистического прогнозирования между дихотомическим DIP и частотой непрерывного мигания в минуту в области под кривой ROC 0, 70.
Выводы
Существует значительная связь между частотой мигания и DIP, как диагностировано по UPDRS. Тем не менее, чувствительность к частоте мигания и специфичность в отношении DIP слишком низки, чтобы заменить шкалы клинических оценок в обычной психиатрической практике.
Пробная регистрация
Исследование было начато более 20 лет назад в 1992 году, когда регистрация испытания не была обычной практикой, поэтому исследование никогда не регистрировалось.
Отчеты о рецензировании
Фон
Распространенность медикаментозного паркинсонизма (DIP) у пациентов с тяжелыми психическими заболеваниями (SMI) варьирует от 36% (1) до 56% (2) и связана с ухудшением качества жизни (3), падением (4) и антипсихотическим воздействием. несоблюдение (5). Тем не менее, DIP плохо распознается, и шкалы оценок DIP и болезни Паркинсона (PD), требующие длительных тренировок, трудно реализовать, поэтому рейтинговые шкалы не подходят для клинической практики (6). Таким образом, простые и легкие в использовании методы диагностики для DIP гарантированы. Диагностические методы, основанные на частоте мерцания в качестве клинического теста для диагностики DIP, были бы хорошей мерой, потому что: (i) оценка частоты мерцания во время разговора проста и быстра, (ii) не требует специального оборудования, (iii) имеет высокий уровень взаимодействия (7), и (iv) исследования в области БП показали, что снижение частоты миганий во время разговора хорошо различает БП и здоровых людей по сравнению с Унифицированной шкалой оценки болезни Паркинсона (UPDRS) (8). Частоту моргания можно легко измерить с помощью мобильных приложений, что позволяет врачам диагностировать DIP.
Участие D2-рецептора было последовательно связано со скоростью спонтанного мигания, как в экспериментах на людях, так и на животных (9). В своей оригинальной работе 1990 года Karson et al. (7) пришли к выводу, что моргания наиболее вероятно генерируются в ретикулярной формации понтиона, и сигналы затем передаются в боковые коленчатые органы. Начиная с этой публикации, насколько нам известно, было опубликовано только три статьи, посвященные изучению частоты моргания при шизофрении. Эти исследования связывали частоту мерцания с различными неврологическими мягкими признаками (NSS) у пациентов (10, 11, 12), однако никакой связи между частотой мерцания и центральной дофаминергической активностью не было обнаружено у здоровых контролей (9). Хотя некоторые исследования показывают, что частота морганий является хорошим клиническим тестом для диагностики БП, насколько нам известно, такого исследования не было опубликовано в отношении использования частоты морганий в качестве клинического теста для DIP у пациентов с тяжелыми психическими заболеваниями (SMI).).
Целью настоящей работы является оценка (i) связи между DIP и частотой мигания и (ii) возможностей использования частоты моргания в качестве клинического теста для диагностики DIP с UPDRS (1, 13) в качестве золотого стандарта. Поскольку целью данной статьи является разработка клинического теста для дифференциации пациентов с SMI с DIP и пациентов с SMI без DIP, пациентов сравнивали с другими пациентами, и контрольная группа здоровых людей не использовалась.
методы
Предметы
Всем 204 пациентам, госпитализированным или получающим структурированную амбулаторную помощь в клинике доктора Каприла, единственной психиатрической больнице на Нидерландских Антильских островах, в 1991 году было предложено принять участие в исследовании экстрапирамидных синдромов Кюрасао, которое проводилось в течение 18 лет (1993, 1994, 1996 годы)., 1997, 1998, 2001 и 2009 гг.) Проспективное натуралистическое последующее исследование. Информированное согласие было получено от всех пациентов, и протокол был одобрен Инспекционным советом Кюрасао. В течение 18 лет наблюдения было проведено в общей сложности 8 оценок, посвященных двигательным расстройствам и использованию лекарств. Подробное описание пациентов и оценки были опубликованы ранее (1).
Критериями включения были минимальный возраст 18 лет и кумулятивное воздействие антипсихотиками не менее 3 месяцев; текущее применение антипсихотиков не требовалось. Критериями исключения были истории неврологических нарушений, влияющих на двигательную функцию, включая БП, и перенесших лоботомию. Пациенты с деменцией (N = 7) или умственной отсталостью (N = 3) в качестве основного диагноза были исключены. Общее количество пациентов составило 191, а набор данных можно получить у соответствующего автора по запросу.
оценки
Версия 3.0 UPDRS использовалась для определения DIP (13). Частота миганий в минуту оценивалась в течение 1 минуты во время разговора при каждом измерении (N = 878) одним автором с помощью секундомера, в то время как другой автор проводил интервью (PvH и GM), более подробное описание теста было опубликовано ранее (1). Оба оценщика являются психиатрами, специализирующимися на двигательных расстройствах. Они были слепы к оценке UPDRS, в то время как оценивали частоту мигания и наоборот. Точное описание условий испытаний можно найти в предыдущей публикации (1). DIP был определен как (i) оценка по меньшей мере «умеренная» (оценка 3, диапазон 0-4) по одному из пунктов брадикинезии (1, (2), 6-14) или две или более оценки «легкая» (оценка 2) по этим пунктам; (ii) оценка жесткости (пункт 3) или тремора (пункт 4-5), по крайней мере, «умеренная». Более строгие критерии, используемые для брадикинезии, были выбраны, так как медлительность может быть также вызвана психическими симптомами или приемом лекарств. Временные точки, в которые пациент набрал «умеренный» или более высокий балл по пункту блефароспазма по шкале оценки дистонии Берк-Фана-Марсдена (BFMDRS), были исключены (N = 54), поскольку блефароспазм может вызывать непроизвольные сокращения век и, следовательно, может быть ошибочно классифицирован как моргание DIP. BFMDRS также оценивался во все моменты времени одними и теми же оценщиками (PvH и GM). Диагноз DSM-III-R и демографические переменные (возраст, пол, диагноз и тип и доза антипсихотика) были извлечены из материалов дела обученным врачом.
Статистический анализ
Анализ проводился с использованием Stata, версия 12 (14). Скорость моргания в минуту (i) использовалась в качестве непрерывной переменной, (ii) дихотомизировалась с использованием точки отсечки 20 морганий в минуту, как это было предложено Fitzpatrick et al. (8) и (iii) как 10-процентные отсечки (в дальнейшем: частота непрерывного и дихотомического мигания и 10-процентная частота мигания соответственно). Используя как дихотомическую частоту морганий, так и 10% -ную процентную частоту морганий, мы рассчитали: (i) чувствительность и специфичность с помощью команды roctab (непараметрический ROC-анализ); (ii) положительное прогностическое значение (PPV) и отрицательное прогностическое значение (NPV) с помощью команды diagt (сводная статистика для диагностических тестов в сравнении с истинным состоянием заболевания). Связь между частотой мигания и DIP как непрерывной переменной была рассчитана с помощью команды регрессии (линейной регрессии). Области под кривыми ROC были рассчитаны: (i) для скорости мерцания 10% -ного процентиля с использованием команды roctab и (ii) для скорости непрерывного мигания в минуту с использованием команды lroc (вычисляет площадь под кривой ROC и строит график кривой) на модели логистического прогнозирования с использованием команды logit (логистическая регрессия, сообщающие коэффициенты) с DIP в качестве дихотомической зависимой переменной и непрерывной частоты морганий, возраста, пола, диагноза (шизофрения или др.) и антипсихотической определенной суточной дозы (DDD) (15) и введите в качестве независимых переменных.
Результаты
В общей сложности 878 оценок у 191 пациента были доступны для анализа. Все пациенты дали письменное информированное согласие. Из выборки 72% были мужчины, 95% были афро-карибского происхождения и 84% имели диагноз шизофрении DSM-III-R. Средний возраст составлял 53 года со стандартным отклонением (SD) 15 лет, распространенность DIP по данным UPDRS составила 36% (317 случаев в 890 измерениях, средняя степень тяжести 20 баллов по UPDRS, SD 12), DIP сохранялась до следующего момент времени в 65% случаев. Средняя частота миганий составила 14 (SD 11) для пациентов с DIP и 19 (SD 14) для пациентов без DIP.
Для дихотомической частоты морганий чувствительность (способность теста правильно обозначить субъекта с положительным заболеванием) составила 77%, специфичность (способность теста правильно обозначить субъекта без заболевания как отрицательный) 38%, PPV 75% (значение существует 75% вероятность того, что если частота миганий пациента ниже 20 миганий в минуту, у пациента действительно есть DIP), а NPV 41% (это означает, что есть вероятность 41%, что если частота мигания пациента выше, чем 20 миганий в минуту) минута, у пациента нет DIP) (Таблица 1). Для чувствительности 10% -ного процентиля мерцания, специфичность, PPV и NPV представлены в таблице 2. Площадь под кривой ROC была 0, 61 (рис. 1). Линейная регрессия дала значимые коэффициенты между DIP и частотой мигания (B - 0, 14, p <0, 000) с R-квадратом объясненной дисперсии 0, 025 или 2, 5%. В модели прогнозирования логистической регрессии, скорректированной с учетом возраста, пола, диагноза и типа и дозы антипсихотического препарата, R-квадрат объяснил, что дисперсия была незначительно выше - 0, 095 или 9, 5% (рис. 2 и таблица 3). ROC, полученная из модели прогнозирования, дала площадь под кривой 0, 70, немного выше, чем ROC для порога 10-го процентиля.
Таблица 1 Паркинсонизм, вызванный лекарственными препаратами, идентифицированный UPDRS как золотой стандарт, основанный на частоте мигания
Таблица в натуральную величину
Таблица 2 Чувствительность, специфичность и положительное и отрицательное прогностическое значение с использованием отсечения 10-го процентиля
Таблица в натуральную величину
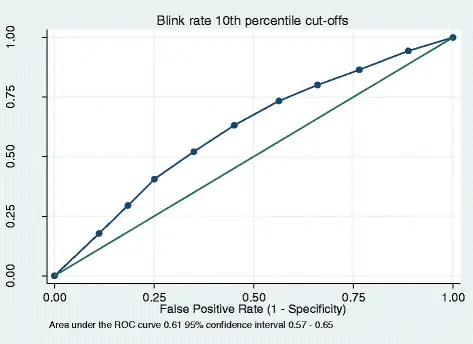
Кривые, управляемые приемником (ROC) для частоты моргания в качестве диагностического инструмента для лечения паркинсонизма, вызванного лекарственными средствами, с использованием порогов 10-го процентиля
Изображение в полном размере
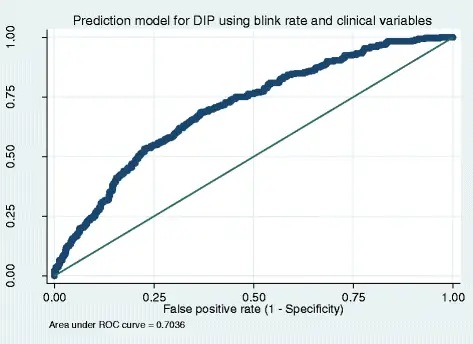
Кривые, управляемые приемником (ROC), построенные по модели прогнозирования лекарственного паркинсонизма с использованием частоты морганий и ковариат
Изображение в полном размере
Таблица 3 Модель прогнозирования лекарственного паркинсонизма с использованием ковариат и частоты непрерывного мигания
Таблица в натуральную величину
обсуждение
Связь между частотой мигания и показателями DIP и UPDRS у пациентов с SMI очень значительна (p <0, 000). Однако объясненная дисперсия в 9, 5% модели логистической регрессии слишком мала, а чувствительность и специфичность частоты моргания слишком низки для использования в качестве клинического инструмента у пациентов со СМИ. При наиболее эффективном отсечении только 62% пациентов были правильно классифицированы по критерию частоты моргания. Другие клинические параметры (которые легко доступны для врачей), которые, как известно, влияют на DIP, такие как возраст, диагноз и пол, были добавлены в модель логистической регрессии. Переменные демонстрировали значительную связь с DIP, однако объясненная дисперсия была все еще слишком низкой, чтобы модель была полезной в клинических условиях.
Настоящие результаты контрастируют с результатами, полученными в PD. Используя ту же точку отсечки 20 морганий в минуту, метаанализ (8) сообщил о чувствительности и специфичности 65% и 83% соответственно, тогда как в настоящем исследовании обнаружена чувствительность и специфичность 77% и 38% соответственно., Возможной причиной расхождения является большая разница в средней частоте морганий между пациентами с БП и здоровыми контролями (18 против 34 морганий) по сравнению с разницей между пациентами с ИМТ с и без ДИП (14 против 19 морганий) в настоящем исследовании. Объяснение состоит в том, что пациенты с БП и здоровыми контролями представляют собой отдельные группы, не сильно перекрывающиеся, тогда как пациенты с SMI в настоящем исследовании происходят из одной и той же популяции и имеют ДИП в непрерывном масштабе.
В настоящем исследовании пациенты с SMI без DIP показали более низкую среднюю частоту мигания в минуту по сравнению со здоровыми контролями из других исследований с аналогичной методологией. Это удивительно, так как исследования последовательно показывают, что у пациентов с шизофренией средняя частота моргания выше, чем у здоровых людей (7, 11, 12), с частотой моргания 27 для пациентов с психотическим расстройством и 22-18 для других психических расстройств. (7). Хотя это различие наиболее заметно у пациентов, не получающих лекарств, с диагнозом шизофрения (7, 11, 12, 16), оно также присутствует у пациентов, получающих лечение от шизофрении (10, 12). Кроме того, частота мигания связана с подмножеством симптомов, таких как галлюцинации и тревожность (10, 11, 12) у пациентов с диагнозом шизофрения. Ассоциации с неврологическими мягкими признаками (10, 11, 16) и антипсихотической дозой (16) были противоречивыми. Вероятно, на частоту мигания у пациентов с шизофренией влияет больше факторов, чем просто DIP. Что это за факторы и как они связаны с текущей популяцией, остается неизвестным. Дальнейшее исследование патофизиологии аномальных частот мигания у пациентов с диагнозом шизофрения является оправданным, поскольку оно может пролить свет на основные механизмы заболевания.
Ограничения
Из-за натуралистической обстановки, четко определенной зоны охвата и широких критериев включения, результаты этого исследования, вероятно, будут хорошим представлением двигательных расстройств в реальной популяции SMI в мире; Баккер и соавт. (17) нашли очень похожие результаты для применения лекарств и двигательных расстройств в голландской популяции. Однако есть ряд ограничений для исследования. Во-первых, частота мигания зависит от контекста и, следовательно, также варьируется между тестами. Несмотря на то, что в этом исследовании не было данных о надежности между оценками, Karson et al. (7) и Fitzpartrick et al. (8) сообщили о хорошей межплатформенной надежности и достоверности оценки скорости моргания во время разговора. Однако сравнение с частотой мигания в других исследованиях, в которых используются разные тесты, затруднено. Во-вторых, более строгие критерии брадикинезии, использованные в текущем исследовании для диагностики DIP (2), не соответствуют сокращению банка головного мозга в Великобритании для БП (18). Тем не менее, после-анализ с использованием отсечения банка мозга Великобритании показали очень похожие результаты. В-третьих, UPDRS является наиболее распространенным инструментом для диагностики БП и является гораздо более полным, чем другие шкалы, используемые для измерения DIP (19). Однако ряд экспериментальных инструментальных измерений как БП (20), так и медикаментозной брадикинезии (21), вероятно, более точен, чем UPDRS, и, следовательно, может привести к более точной диагностике ДИП и, возможно, к более высокой чувствительности и специфичности для частоты моргания., В-четвертых, повторные измерения с течением времени могут привести к смещению при дифференциальном истощении. Однако последующие анализы только с одним измерением на пациента показали очень похожие результаты. Наконец, Аннамалай и соавт. (22) обнаружили связь между курением и никотином в их влиянии на дофаминергическую систему. К сожалению, в текущем исследовании данные о курении отсутствуют. Однако очень маловероятно, что добавление переменной курения в модель логистической регрессии окажет существенное влияние на чувствительность и специфичность теста.
Выводы
Существует значительная связь между частотой мигания и DIP, как диагностировано по UPDRS. К сожалению, чувствительность и специфичность мерцания в отношении этих результатов слишком низки, чтобы заменить шкалы оценок клиницистов в повседневной практике. Тем не менее, по-прежнему существует потребность в более простом и доступном способе диагностики двигательных расстройств в службах психического здоровья, поскольку ДИП широко распространен у пациентов со СМИ (1, 2, 19) и отрицательно влияет на качество жизни. DIP в настоящее время недостаточно диагностируется (19, 20, 21), поскольку шкалы клинических оценок представляют ряд проблем для использования в повседневной клинической практике (20, 21). Поэтому будущие исследования и клиническая практика по диагностированию DIP могут быть обеспечены путем сочетания Частота морганий при измерениях на приборе, например, тест на постукивание пальцем, тест на тремор и / или тест на скорость реакции. Все эти меры могут быть запрограммированы как приложение на мобильном устройстве для простоты использования. Больше исследований должно быть сделано в действительности этих комбинаций.
Сокращения
- BFMDRS:
- Рейтинговая шкала Берк Фан Марсден Дистония
- DIP:
- Лекарственный паркинсонизм
- NPV:
- Отрицательная прогностическая ценность
- PD:
- болезнь Паркинсона
- PPV:
- Положительная прогностическая ценность
- SMI:
- Тяжелая психическая болезнь
- UPDRS:
- Единая шкала оценки болезни Паркинсона
