1. Диагностика заболеваний предстательной железы
1.1. Мультипараметрическая МРТ
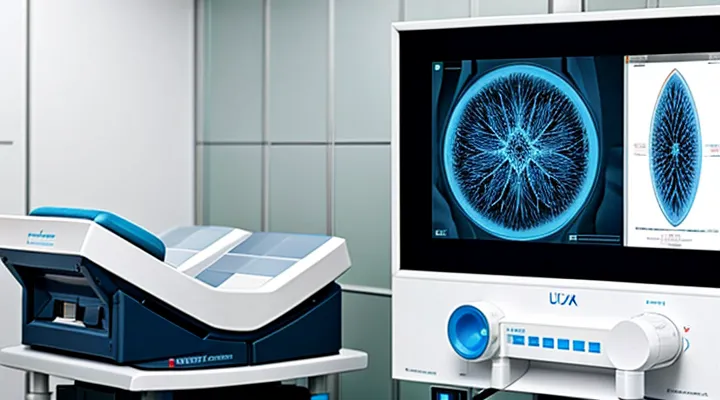
Мультипараметрическая магнитно-резонансная томография (МРТ) представляет собой современный диагностический метод, который активно применяется для выявления и оценки заболеваний предстательной железы. Этот подход объединяет несколько режимов сканирования, включая T2-взвешенные изображения, диффузионно-взвешенную визуализацию и динамическое контрастирование, что позволяет получить комплексную информацию о структуре и функциях тканей.
Преимущество мультипараметрической МРТ заключается в её способности дифференцировать злокачественные и доброкачественные изменения в предстательной железе с высокой точностью. Это особенно важно при диагностике рака простаты, где раннее выявление и точная локализация опухоли напрямую влияют на выбор тактики лечения. Метод также используется для оценки степени агрессивности опухоли, что помогает врачам принимать обоснованные решения о необходимости биопсии или других вмешательств.
Кроме того, мультипараметрическая МРТ позволяет избежать излишних инвазивных процедур, таких как повторные биопсии, за счёт точного определения подозрительных участков. Это снижает риски для пациента и повышает эффективность диагностического процесса. Технология также находит применение в планировании лучевой терапии и хирургических вмешательств, обеспечивая более точное наведение на патологические очаги.
С развитием искусственного интеллекта и алгоритмов обработки изображений точность интерпретации данных мультипараметрической МРТ продолжает расти. Это открывает новые возможности для персонализированного подхода к лечению заболеваний предстательной железы, что делает метод незаменимым инструментом в современной урологии.
1.2. Биопсия с использованием навигации
Биопсия с использованием навигации представляет собой современный метод диагностики заболеваний предстательной железы, который значительно повышает точность и безопасность процедуры. Этот подход сочетает в себе традиционную биопсию с передовыми технологиями визуализации и навигации, что позволяет врачам точно определять подозрительные участки ткани. Технология включает использование мультипараметрической магнитно-резонансной томографии (МРТ) для предварительной оценки железы и создания трехмерной карты, которая интегрируется с ультразвуковым оборудованием в реальном времени. Это обеспечивает точное наведение иглы на целевые области, даже если они расположены в труднодоступных зонах.
Преимущества биопсии с использованием навигации очевидны. Во-первых, она снижает вероятность пропуска значимых очагов опухоли, что особенно актуально при ранней диагностике рака предстательной железы. Во-вторых, метод минимизирует повреждение здоровых тканей, что уменьшает риск осложнений, таких как кровотечение или инфекция. В-третьих, процедура становится менее инвазивной и более комфортной для пациента, что особенно важно при необходимости повторных исследований.
Внедрение этой технологии требует специализированного оборудования и обучения медицинского персонала, однако ее применение уже доказало свою эффективность в клинической практике. Биопсия с использованием навигации становится стандартом диагностики, позволяя врачам принимать более обоснованные решения о дальнейшем лечении. С развитием технологий и их доступности этот метод может стать основным инструментом в диагностике заболеваний предстательной железы, обеспечивая высокую точность и безопасность для пациентов.
1.3. Анализ мочи на генетические маркеры
Анализ мочи на генетические маркеры представляет собой современный диагностический метод, который активно внедряется в медицинскую практику для выявления заболеваний предстательной железы. Этот подход основан на обнаружении специфических биомолекул, таких как РНК, ДНК или белки, которые выделяются с мочой и могут указывать на наличие патологических процессов. Генетические маркеры позволяют не только диагностировать заболевание на ранних стадиях, но и оценивать его агрессивность, что имеет большое значение для выбора стратегии лечения.
Одним из ключевых преимуществ анализа мочи на генетические маркеры является его неинвазивность. В отличие от биопсии, которая требует взятия образцов тканей, этот метод исключает риски, связанные с хирургическими вмешательствами. Кроме того, он может использоваться для мониторинга эффективности проводимой терапии, что делает его ценным инструментом в долгосрочном наблюдении за пациентами.
Среди генетических маркеров, которые изучаются в рамках этого анализа, особое внимание уделяется экспрессии генов, связанных с развитием рака предстательной железы. Например, обнаружение повышенных уровней PCA3 или TMPRSS2-ERG в моче может свидетельствовать о наличии злокачественного процесса. Эти данные позволяют врачам принимать более обоснованные решения о необходимости дальнейших исследований или начале лечения.
Внедрение анализа мочи на генетические маркеры в клиническую практику способствует персонализации медицины. Он позволяет учитывать индивидуальные особенности пациента, что повышает точность диагноза и эффективность терапии. Благодаря этому методу врачи могут своевременно выявлять заболевание, минимизируя риски его прогрессирования и улучшая прогноз для пациентов.
Таким образом, анализ мочи на генетические маркеры становится важным элементом в арсенале современных методов диагностики и лечения заболеваний предстательной железы, открывая новые возможности для раннего выявления и контроля патологий.
2. Малоинвазивные хирургические методы
2.1. Лазерная вапоризация простаты
Лазерная вапоризация простаты представляет собой современный метод лечения доброкачественной гиперплазии предстательной железы (ДГПЖ), который активно внедряется в урологическую практику. Этот метод основан на использовании лазерной энергии для испарения гиперплазированной ткани предстательной железы, что позволяет уменьшить объем органа и устранить симптомы, связанные с обструкцией мочевыводящих путей.
Преимущество лазерной вапоризации заключается в ее минимальной инвазивности и высокой точности. Процедура выполняется через уретру с помощью специального эндоскопического оборудования, что исключает необходимость открытых хирургических вмешательств. Лазерный луч воздействует на ткань простаты, испаряя ее и одновременно коагулируя сосуды, что значительно снижает риск кровотечения.
Ключевыми достоинствами метода являются короткий период восстановления, низкая вероятность осложнений и возможность проведения у пациентов с сопутствующими заболеваниями, для которых традиционные хирургические методы могут быть противопоказаны. Кроме того, лазерная вапоризация позволяет сохранить эякуляторную функцию, что особенно важно для молодых пациентов.
Технология активно развивается, появляются новые типы лазеров, такие как гольмиевый и тулиевый, которые обеспечивают еще более высокую эффективность и безопасность. Однако успех процедуры во многом зависит от опыта хирурга и правильного отбора пациентов.
Лазерная вапоризация простаты уже доказала свою эффективность в клинической практике и продолжает расширять свои возможности, предлагая пациентам с ДГПЖ современное и комфортное решение их проблем.
2.2. Трансуретральная микроволновая термотерапия (TUMT)
Трансуретральная микроволновая термотерапия (TUMT) представляет собой современный метод лечения доброкачественной гиперплазии предстательной железы (ДГПЖ), который активно применяется в урологической практике. Данная технология основана на воздействии микроволновой энергии, которая генерируется специальным устройством и передается через уретру к тканям простаты. Под влиянием тепла происходит коагуляция и уменьшение объема гиперплазированных тканей, что способствует снижению обструкции мочевыводящих путей.
Процедура TUMT выполняется под местной или регионарной анестезией, что делает ее менее инвазивной по сравнению с хирургическими вмешательствами. Во время сеанса врач вводит катетер с микроволновым излучателем в уретру, после чего начинается процесс нагревания тканей простаты до температуры 45–55°C. Это приводит к разрушению клеток, вызывающих сдавление мочеиспускательного канала, и улучшает отток мочи. Длительность процедуры обычно составляет 30–60 минут, а пациент может покинуть клинику в тот же день.
Преимущества TUMT включают минимальный риск осложнений, короткий восстановительный период и высокую эффективность в устранении симптомов ДГПЖ. К наиболее частым побочным эффектам относятся временные нарушения мочеиспускания, такие как учащенные позывы или легкий дискомфорт, которые обычно проходят в течение нескольких дней. По сравнению с трансуретральной резекцией простаты (ТУРП), TUMT менее травматична, что делает ее предпочтительным выбором для пациентов с противопоказаниями к хирургическому лечению.
Важным аспектом TUMT является возможность ее применения у пациентов с сопутствующими заболеваниями, такими как сердечно-сосудистые патологии или нарушения свертываемости крови, которые могут ограничивать использование других методов лечения. Кроме того, технология позволяет сохранить сексуальную функцию, что является значимым преимуществом для многих мужчин. Современные устройства для TUMT оснащены системами контроля температуры, что минимизирует риск повреждения окружающих тканей и повышает безопасность процедуры.
В заключение, трансуретральная микроволновая термотерапия зарекомендовала себя как эффективный и безопасный метод лечения ДГПЖ, который сочетает в себе минимальную инвазивность и высокую результативность. Ее применение позволяет улучшить качество жизни пациентов, снизить симптоматику и избежать необходимости в более радикальных вмешательствах.
2.3. Трансуретральная электропорация (TUIP)
Трансуретральная электропорация (TUIP) представляет собой инновационный метод лечения заболеваний предстательной железы, основанный на использовании электрических импульсов для создания микроскопических пор в клеточных мембранах. Этот процесс позволяет доставлять лекарственные препараты или разрушать патологические ткани с высокой точностью и минимальным повреждением окружающих здоровых структур. TUIP выполняется через уретру, что исключает необходимость хирургических разрезов и сокращает период восстановления пациента.
Технология TUIP особенно эффективна при лечении доброкачественной гиперплазии предстательной железы (ДГПЖ) и некоторых форм рака простаты. Электрические импульсы, генерируемые специальным устройством, вызывают временное увеличение проницаемости клеточных мембран, что облегчает проникновение терапевтических агентов. В случае ДГПЖ TUIP может способствовать уменьшению объема предстательной железы и устранению симптомов, таких как затрудненное мочеиспускание. При онкологических заболеваниях метод позволяет точечно воздействовать на опухолевые клетки, минимизируя побочные эффекты.
Преимущества TUIP включают низкий уровень инвазивности, высокую точность воздействия и возможность амбулаторного проведения процедуры. Пациенты отмечают быстрое улучшение состояния и возвращение к привычному образу жизни. Однако метод требует использования специализированного оборудования и высокой квалификации врачей, что может ограничивать его доступность. Тем не менее, TUIP продолжает активно изучаться и совершенствоваться, открывая новые перспективы в лечении заболеваний предстательной железы.
2.4. Водяная абляция простаты (Rezum)
Водяная абляция простаты, известная как Rezum, представляет собой современный метод лечения доброкачественной гиперплазии предстательной железы (ДГПЖ). Эта технология основана на использовании пара, который доставляется непосредственно в ткань простаты через специальный зонд. Под воздействием высокой температуры происходит контролируемое разрушение избыточной ткани, что приводит к уменьшению объема железы и облегчению симптомов, связанных с обструкцией мочевыводящих путей.
Процедура выполняется под местной анестезией и длится в среднем 10–15 минут. Основное преимущество Rezum заключается в минимальной инвазивности, что снижает риск осложнений и сокращает период восстановления. Пациенты обычно возвращаются к привычному образу жизни уже через несколько дней после вмешательства. Кроме того, метод не требует резекции тканей, что минимизирует кровопотерю и исключает необходимость длительного катетеризации.
Эффективность водяной абляции подтверждена клиническими исследованиями, которые демонстрируют значительное улучшение показателей мочеиспускания у пациентов с ДГПЖ. Уменьшение объема простаты и устранение симптомов наблюдаются у большинства пациентов в течение нескольких недель после процедуры. При этом риск развития таких осложнений, как эректильная дисфункция или недержание мочи, значительно ниже по сравнению с традиционными хирургическими методами.
Rezum также подходит для пациентов с крупными размерами простаты, что расширяет возможности его применения. Технология позволяет избежать радикальных операций, таких как трансуретральная резекция простаты (ТУРП) или простатэктомия, что особенно важно для пациентов с сопутствующими заболеваниями, которые могут увеличивать риск хирургических вмешательств.
Водяная абляция простаты является примером инновационного подхода к лечению ДГПЖ, сочетающего эффективность, безопасность и минимальную инвазивность. Этот метод продолжает развиваться, открывая новые перспективы для улучшения качества жизни пациентов с заболеваниями предстательной железы.
3. Роботизированная хирургия
3.1. Роботизированная радикальная простатэктомия
Роботизированная радикальная простатэктомия представляет собой современный хирургический метод удаления предстательной железы, который активно применяется при лечении локализованного рака простаты. Эта технология основана на использовании роботизированных систем, таких как da Vinci, которые позволяют хирургу выполнять операции с высокой точностью и минимальной инвазивностью. В отличие от традиционной открытой хирургии, роботизированная простатэктомия осуществляется через небольшие разрезы, что значительно снижает кровопотерю, сокращает период восстановления и уменьшает риск послеоперационных осложнений.
Основное преимущество роботизированной простатэктомии заключается в улучшенной визуализации операционного поля. Хирург работает с трехмерным изображением высокой четкости, что позволяет точно идентифицировать анатомические структуры и минимизировать повреждение окружающих тканей. Это особенно важно для сохранения нервных пучков, ответственных за эректильную функцию, и удержания мочи. Благодаря этому пациенты после операции быстрее возвращаются к нормальной жизни и имеют более высокие шансы на сохранение качества жизни.
Еще одним значимым аспектом является снижение болевых ощущений в послеоперационный период. Малоинвазивный подход уменьшает травматичность процедуры, что позволяет пациентам быстрее восстановиться и сократить сроки пребывания в стационаре. Кроме того, использование роботизированных систем обеспечивает высокую повторяемость результатов, что делает метод надежным и предсказуемым.
Несмотря на очевидные преимущества, роботизированная радикальная простатэктомия требует от хирурга специальной подготовки и опыта работы с высокотехнологичным оборудованием. Это связано с необходимостью адаптации к особенностям управления роботизированной системой и освоения новых навыков. Тем не менее, с развитием технологий и увеличением доступности таких систем, данный метод становится все более распространенным в клинической практике.
В целом, роботизированная радикальная простатэктомия демонстрирует высокую эффективность в лечении рака предстательной железы, сочетая в себе минимальную инвазивность, точность выполнения и улучшенные функциональные результаты. Это делает ее одним из наиболее перспективных методов в современной урологической хирургии.
3.2. Роботизированная простая простатэктомия
Роботизированная простая простатэктомия представляет собой современный хирургический метод удаления предстательной железы с использованием роботизированной системы, такой как da Vinci. Этот подход отличается высокой точностью, минимальной инвазивностью и сокращением периода восстановления.
Основное преимущество технологии заключается в трехмерной визуализации операционного поля и повышенной маневренности инструментов. Хирург управляет роботизированными манипуляторами через консоль, что позволяет выполнять точные движения с уменьшенным риском повреждения окружающих тканей.
Показаниями к проведению роботизированной простой простатэктомии являются доброкачественная гиперплазия предстательной железы (ДГПЖ) и другие неонкологические состояния, требующие удаления органа. По сравнению с открытой хирургией данный метод снижает кровопотерю, минимизирует болевой синдром и сокращает госпитализацию до 1–2 дней.
Несмотря на высокую эффективность, методика требует от хирурга специальной подготовки и наличия дорогостоящего оборудования. Кроме того, в редких случаях возможны осложнения, такие как временное недержание мочи или инфекции. Тем не менее роботизированная простатэктомия продолжает развиваться, повышая качество лечения пациентов с патологиями простаты.
4. Таргетная терапия
4.1. Фокальная терапия (HIFU, криотерапия)
Фокальная терапия, включающая методы HIFU (высокоинтенсивный сфокусированный ультразвук) и криотерапию, представляет собой современный подход к лечению заболеваний предстательной железы. Эти методы направлены на локальное воздействие на пораженные участки, что минимизирует повреждение здоровых тканей и сокращает период восстановления.
HIFU основан на использовании ультразвуковых волн высокой интенсивности, которые фокусируются в конкретной зоне предстательной железы, вызывая термическое разрушение патологических клеток. Преимущества метода включают высокую точность, минимальную инвазивность и возможность повторного применения при необходимости. Криотерапия, в свою очередь, подразумевает замораживание опухолевой ткани с помощью жидкого азота или аргона, что приводит к некрозу пораженных участков. Этот метод особенно эффективен при локализованных формах рака предстательной железы.
Основные показания для фокальной терапии включают ограниченные опухоли без признаков метастазирования, а также случаи, когда пациент не подходит для радикального хирургического вмешательства. К преимуществам этих методов относятся сохранение эректильной функции и мочеиспускания, что значительно улучшает качество жизни пациентов. Однако важным аспектом остается тщательный отбор кандидатов, так как не все случаи подходят для фокального лечения.
Долгосрочные результаты HIFU и криотерапии продолжают изучаться, но уже сейчас они демонстрируют высокую эффективность при соблюдении строгих критериев отбора. Эти технологии дополняют арсенал современных методов лечения, предлагая пациентам менее травматичные альтернативы. Развитие фокальной терапии открывает новые перспективы в персонализированном подходе к лечению заболеваний предстательной железы.
4.2. Брахитерапия
Брахитерапия представляет собой метод лучевой терапии, при котором радиоактивные источники помещаются непосредственно в пораженную ткань предстательной железы. Этот подход позволяет доставлять высокие дозы радиации точно в зону опухоли, минимизируя воздействие на окружающие здоровые ткани. Брахитерапия особенно эффективна при лечении локализованного рака предстательной железы, когда опухоль ограничена пределами органа. Метод может применяться как самостоятельное лечение или в комбинации с другими видами терапии, такими как внешняя лучевая терапия или гормональное лечение.
Существует два основных типа брахитерапии: низкодозная и высокодозная. Низкодозная брахитерапия предполагает имплантацию постоянных радиоактивных зерен, которые постепенно высвобождают радиацию в течение нескольких недель или месяцев. Этот метод требует однократной процедуры и подходит для пациентов с низким и средним риском прогрессирования заболевания. Высокодозная брахитерапия, напротив, использует временные источники излучения, которые удаляются после завершения сеанса. Этот вариант часто применяется в сочетании с внешней лучевой терапией и рекомендуется пациентам с более агрессивными формами рака.
Преимущества брахитерапии включают высокую точность воздействия, снижение риска побочных эффектов по сравнению с традиционной лучевой терапией и возможность сохранения функций мочевого пузыря и прямой кишки. Процедура обычно проводится под анестезией и занимает относительно короткое время. Пациенты могут вернуться к обычной жизни уже через несколько дней после вмешательства. Однако, как и любой метод лечения, брахитерапия имеет свои ограничения и риски, такие как возможное развитие лучевого цистита, проктита или эректильной дисфункции.
Современные технологии значительно улучшили точность и безопасность брахитерапии. Использование трехмерного планирования, ультразвукового и МРТ-наведения позволяет максимально точно размещать радиоактивные источники. Это снижает вероятность повреждения здоровых тканей и повышает эффективность лечения. Продолжающиеся исследования и разработки в области брахитерапии открывают новые перспективы для ее применения, включая адаптацию метода для более сложных случаев и повышение комфорта пациентов.
4.3. Направленная лекарственная доставка
Направленная лекарственная доставка представляет собой перспективный метод повышения эффективности терапии заболеваний предстательной железы. Этот подход позволяет минимизировать побочные эффекты за счет точного воздействия на пораженные ткани, исключая влияние на здоровые органы. Современные разработки включают использование наноносителей, таких как липосомы, полимерные частицы и дендримеры, которые способны преодолевать биологические барьеры и высвобождать препараты непосредственно в зоне патологии.
Одним из ключевых преимуществ является возможность комбинирования нескольких терапевтических агентов в одной системе доставки. Например, сочетание химиотерапевтических средств и иммуномодуляторов усиливает противоопухолевый эффект. Кроме того, применение магнитных или ультразвуковых методов управления наночастицами повышает точность доставки, что особенно актуально при лечении локализованных форм рака предстательной железы.
Другой важный аспект — использование таргетных лигандов, таких как антитела или пептиды, специфически связывающиеся с рецепторами на поверхности раковых клеток. Это обеспечивает селективное накопление препаратов в опухоли, снижая токсичность для организма. Перспективным направлением также остается разработка стимул-чувствительных систем, высвобождающих лекарство под действием определенных факторов микроокружения опухоли, таких как pH или ферментативная активность.
Клинические исследования подтверждают значительное улучшение выживаемости пациентов при применении направленной доставки по сравнению с традиционной химиотерапией. Однако остаются вызовы, связанные с масштабированием технологий, регуляторными аспектами и долгосрочной безопасностью. Несмотря на это, прогресс в этой области открывает новые возможности для персонализированного лечения, повышая шансы на ремиссию и улучшая качество жизни пациентов.
5. Иммунотерапия и генная терапия
5.1. Вакцины против рака предстательной железы
Разработка вакцин против рака предстательной железы представляет собой одно из наиболее перспективных направлений в современной онкологии. В отличие от традиционных подходов, таких как химиотерапия или лучевая терапия, вакцины направлены на активацию собственной иммунной системы пациента для борьбы с опухолевыми клетками. Это позволяет не только уничтожать уже существующие раковые клетки, но и предотвращать их повторное появление, что особенно важно при лечении рецидивирующих форм заболевания.
Одним из наиболее изученных подходов является использование терапевтических вакцин, таких как Sipuleucel-T. Эта вакцина создается на основе дендритных клеток пациента, которые модифицируются для распознавания специфических антигенов рака предстательной железы, в частности, простатической кислой фосфатазы (PAP). После введения в организм эти клетки стимулируют иммунный ответ, направленный на уничтожение опухоли. Клинические исследования показали, что Sipuleucel-T способен увеличивать выживаемость пациентов с метастатическим гормонорезистентным раком предстательной железы.
Помимо этого, активно разрабатываются вакцины на основе мРНК-технологий, которые позволяют быстро создавать персонализированные препараты. Такие вакцины содержат информацию о специфических мутациях опухоли пациента, что делает их высокоэффективными в борьбе с индивидуальными особенностями заболевания. Этот подход уже демонстрирует впечатляющие результаты в других областях онкологии, что открывает новые перспективы для лечения рака предстательной железы.
Важным аспектом является также комбинирование вакцин с другими методами лечения, такими как иммунотерапия ингибиторами контрольных точек или гормональная терапия. Это позволяет усилить эффективность лечения и преодолеть резистентность опухоли к монотерапии. Например, сочетание вакцин с препаратами, блокирующими PD-1 или CTLA-4, может значительно повысить иммунный ответ и улучшить прогноз для пациентов.
Несмотря на значительные успехи, разработка и внедрение вакцин против рака предстательной железы сталкиваются с рядом вызовов. Это включает необходимость точного подбора антигенов, обеспечение безопасности и эффективности препаратов, а также оптимизацию протоколов лечения. Однако постоянное совершенствование технологий и углубление понимания механизмов иммунного ответа позволяют рассчитывать на дальнейший прогресс в этой области.
5.2. Генная модификация иммунных клеток
Генная модификация иммунных клеток представляет собой перспективное направление в терапии заболеваний предстательной железы, включая рак. Метод основан на изменении структуры Т-лимфоцитов пациента для усиления их способности распознавать и уничтожать опухолевые клетки. В лабораторных условиях у пациента забирают образец иммунных клеток, после чего с помощью методов генной инженерии в них встраивают химерные антигенные рецепторы (CAR). Эти рецепторы позволяют Т-клеткам целенаправленно атаковать злокачественные образования, экспрессирующие специфические маркеры, такие как PSMA.
После модификации клетки размножают и вводят обратно в организм. Клинические исследования демонстрируют высокую эффективность метода у пациентов с устойчивыми к стандартной терапии формами рака предстательной железы. Одним из ключевых преимуществ является длительная персистенция модифицированных клеток в организме, что снижает риск рецидива.
Несмотря на впечатляющие результаты, технология требует дальнейшей доработки. Потенциальные побочные эффекты, включая цитокиновый шторм и аутоиммунные реакции, остаются важными проблемами для исследователей. Кроме того, высокая стоимость процедуры ограничивает её широкое применение. Однако прогресс в области генного редактирования, в частности использование CRISPR-Cas9, открывает новые пути для оптимизации метода, делая его более точным и безопасным.
Развитие персонализированных подходов на основе генной модификации иммунных клеток может кардинально изменить стратегию лечения агрессивных форм рака простаты. Уже сегодня этот метод рассматривается как один из наиболее многообещающих в онкоурологии, демонстрирующий потенциал для достижения длительной ремиссии даже на поздних стадиях заболевания.
6. Новые фармакологические подходы
6.1. Ингибиторы андрогенных рецепторов нового поколения
Ингибиторы андрогенных рецепторов нового поколения представляют собой перспективное направление в терапии заболеваний предстательной железы, включая рак простаты. Эти препараты разработаны для более эффективного блокирования активности андрогенов, которые стимулируют рост и развитие опухолевых клеток. В отличие от традиционных антиандрогенов, новые ингибиторы обладают повышенной селективностью и способностью преодолевать резистентность, что делает их особенно ценными при лечении кастрационно-резистентного рака простаты. Современные препараты, такие как энзалутамид и апалутамид, демонстрируют высокую эффективность в подавлении активности андрогенных рецепторов даже при наличии мутаций, которые ранее делали лечение менее успешным.
Механизм действия этих препаратов основан на связывании с андрогенными рецепторами, что предотвращает их активацию и последующую передачу сигналов, стимулирующих рост опухоли. Кроме того, ингибиторы нового поколения способны подавлять миграцию и инвазию раковых клеток, что снижает риск метастазирования. Клинические исследования подтверждают их способность значительно продлевать выживаемость пациентов, а также улучшать качество жизни за счет уменьшения симптомов заболевания.
Разработка и внедрение этих препаратов стали возможны благодаря углубленному пониманию молекулярных механизмов развития рака простаты. Ученые активно исследуют возможности комбинированной терапии, сочетающей ингибиторы андрогенных рецепторов с другими методами лечения, такими как лучевая терапия или иммунотерапия. Это позволяет достичь более выраженного терапевтического эффекта и преодолеть ограничения монотерапии.
Несмотря на значительные успехи, перед исследователями остаются вызовы, связанные с необходимостью минимизировать побочные эффекты и повысить доступность этих препаратов для широкого круга пациентов. Постоянное совершенствование технологий и подходов к лечению открывает новые перспективы в борьбе с заболеваниями предстательной железы, делая ингибиторы андрогенных рецепторов важным инструментом в арсенале современной медицины.
6.2. Радиолигандная терапия
Радиолигандная терапия представляет собой инновационный подход в лечении заболеваний предстательной железы, основанный на использовании радиоактивных изотопов, которые избирательно связываются с молекулами-мишенями в опухолевых клетках. Этот метод позволяет доставлять высокие дозы радиации непосредственно к злокачественным тканям, минимизируя воздействие на здоровые органы и ткани. Основным принципом является применение радиофармацевтических препаратов, состоящих из радиоактивного изотопа и лиганда — молекулы, способной распознавать специфические антигены на поверхности раковых клеток.
Одним из наиболее известных препаратов для радиолигандной терапии при раке предстательной железы является лютеций-177-PSMA. Этот препарат нацелен на простат-специфический мембранный антиген (PSMA), который экспрессируется в большом количестве на поверхности опухолевых клеток. После введения препарата в организм, он связывается с PSMA, что позволяет радиоактивному изотопу воздействовать непосредственно на опухоль, разрушая её изнутри.
Клинические исследования подтвердили эффективность радиолигандной терапии у пациентов с метастатическим кастрационно-резистентным раком предстательной железы. У таких больных этот метод способствует замедлению прогрессирования заболевания, уменьшению болевого синдрома и улучшению качества жизни. Кроме того, радиолигандная терапия может быть использована в комбинации с другими методами лечения, такими как гормональная терапия или химиотерапия, для достижения максимального терапевтического эффекта.
Безопасность метода также является важным аспектом. Благодаря избирательному действию, радиолигандная терапия вызывает меньше побочных эффектов по сравнению с традиционной лучевой терапией. Однако, как и любой метод, она требует тщательного отбора пациентов и контроля за состоянием их здоровья во время и после лечения.
Развитие радиолигандной терапии открывает новые перспективы в лечении заболеваний предстательной железы, особенно в случаях, когда традиционные методы оказываются недостаточно эффективными. Этот подход продолжает активно изучаться, что позволяет совершенствовать методики и расширять возможности его применения в клинической практике.
6.3. Ингибиторы PARP
Ингибиторы PARP представляют собой перспективный класс препаратов, активно исследуемых в терапии заболеваний предстательной железы. Эти вещества блокируют фермент поли(АДФ-рибозо)полимеразу (PARP), который участвует в восстановлении повреждений ДНК. В частности, ингибиторы PARP эффективны в случаях, когда у пациентов выявлены мутации в генах, связанных с репарацией ДНК, таких как BRCA1 и BRCA2. Такие мутации часто встречаются у мужчин с кастрационно-резистентным раком предстательной железы (КРРПЖ).
Механизм действия ингибиторов PARP основан на принципе синтетической летальности. При подавлении активности PARP в клетках с уже нарушенной системой репарации ДНК накапливаются неисправленные повреждения, что приводит к гибели раковых клеток. Это делает их особенно эффективными при лечении опухолей с дефектами в генах, отвечающих за восстановление ДНК. Клинические исследования подтвердили, что ингибиторы PARP, такие как олапариб и рукапариб, улучшают показатели выживаемости и замедляют прогрессирование заболевания у пациентов с КРРПЖ.
Одним из ключевых преимуществ ингибиторов PARP является их способность воздействовать на опухоли, устойчивые к традиционным методам лечения, включая гормональную терапию и химиотерапию. Это открывает новые возможности для персонализированного подхода к лечению, особенно для пациентов с генетическими предрасположенностями. Однако важно учитывать, что использование этих препаратов может сопровождаться побочными эффектами, такими как анемия, утомляемость и желудочно-кишечные расстройства, что требует тщательного мониторинга состояния пациентов.
Современные исследования продолжают расширять понимание роли ингибиторов PARP в терапии рака предстательной железы. Ученые изучают их комбинацию с другими методами лечения, включая иммунотерапию и таргетные препараты, что может повысить их эффективность и снизить риск развития резистентности. Разработка новых ингибиторов PARP и оптимизация их применения остаются важными направлениями в онкологии, способными улучшить прогнозы для пациентов с агрессивными формами заболевания.
7. Персонализированная медицина
7.1. Геномное профилирование опухоли
Геномное профилирование опухоли стало мощным инструментом в персонализации лечения рака предстательной железы. Эта технология позволяет анализировать генетические мутации, хромосомные перестройки и экспрессию генов в опухолевых клетках. Результаты такого анализа помогают выявить молекулярные особенности конкретного новообразования, что открывает возможности для более точного подбора терапии.
Современные методы секвенирования, такие как полногеномное или экзомное секвенирование, обеспечивают детальную характеристику опухоли. Например, выявление мутаций в генах BRCA1/2, PTEN или изменения в сигнальных путях AR, PI3K-AKT позволяет использовать таргетные препараты. Это особенно актуально для пациентов с агрессивными или резистентными формами заболевания.
Геномное профилирование также помогает предсказать ответ на иммунотерапию. Анализ нагрузки соматических мутаций (TMB) или статуса микросателлитной нестабильности (MSI) определяет вероятность эффективности ингибиторов контрольных точек. В случаях, когда стандартные методы лечения не дают результата, такие данные становятся основой для выбора альтернативных схем.
Важным аспектом является интеграция геномного профилирования в клиническую практику. Специалисты могут использовать полученную информацию не только для лечения, но и для оценки прогноза. Например, наличие определенных геномных маркеров коррелирует с риском прогрессирования или развития метастазов. Это позволяет своевременно корректировать тактику ведения пациента.
Перспективы технологии связаны с дальнейшим развитием биоинформатических инструментов и накоплением данных. Углубленное изучение молекулярных механизмов рака предстательной железы способствует появлению новых терапевтических мишеней. В ближайшие годы геномное профилирование может стать стандартом диагностики, обеспечивая индивидуальный подход к каждому случаю.
7.2. Использование искусственного интеллекта для прогнозирования эффективности лечения
Искусственный интеллект активно внедряется в медицинскую практику для повышения точности прогнозирования эффективности лечения заболеваний предстательной железы. Алгоритмы машинного обучения анализируют большие массивы данных, включая клинические показатели, результаты биопсии, генетические маркеры и историю болезни пациента. Это позволяет создавать персонализированные прогнозы, учитывающие индивидуальные особенности течения заболевания.
Одним из ключевых направлений является анализ медицинских изображений, таких как МРТ и КТ. Специализированные нейросети выявляют патологические изменения в тканях, определяют стадию опухоли и прогнозируют ответ на терапию. Например, алгоритмы способны предсказать, насколько эффективной окажется лучевая терапия или хирургическое вмешательство для конкретного пациента.
Еще одно перспективное применение – обработка данных о молекулярно-генетических особенностях опухоли. Искусственный интеллект помогает выявлять паттерны, связанные с агрессивностью рака и устойчивостью к определенным препаратам. Это дает возможность корректировать схему лечения на ранних этапах, избегая неэффективных методов.
Внедрение ИИ также способствует оптимизации клинических исследований. Алгоритмы ускоряют анализ данных, выявляют потенциальных кандидатов для новых методов терапии и сокращают время на разработку персонализированных подходов. Таким образом, прогностические модели на основе искусственного интеллекта становятся незаменимым инструментом для повышения качества медицинской помощи.