Фон
Селективные модуляторы глюкокортикоидных рецепторов (SEGRM) включают новый класс лекарственных средств, обещающих как сниженные побочные эффекты, так и сходную фармакологическую активность по сравнению с глюкокортикоидами, которые в настоящее время служат единственным клиническим лечением для многих отологических расстройств. В первом отологическом эксперименте SEGRM на модели шумовой травмы на животных мы сравниваем эффекты соединения A (SEGRM) и дексаметазона (мощный глюкокортикоид).
методы
Сорок взрослых морских свинок получали экспериментальное лечение один раз в день в течение десяти дней. Животные были разделены на четыре группы на основе полученной обработки: соединение А (1 мг / кг или 3 мг / кг), дексаметазон (1 мг / кг) в качестве золотого стандарта или вода в качестве отрицательного контроля. После пяти применений животные подвергались широкополосному шуму (8-16 кГц) при 115 дБ в течение трех часов. Пороговые значения слуха определяли путем регистрации ответов слухового ствола мозга на щелчки и шумовые всплески (1-32 кГц) и оценивали за неделю до и сразу после воздействия, а также в дни 1, 3, 7, 14, 21 и 28. Улитки готовили в виде целых или встроенных и разрезали для гистологического анализа.
Результаты
Относительно контрольных обработок Соединение А не смогло сохранить слуховые пороги после воздействия шума со статистической значимостью. Гистологические анализы подтверждают физиологический результат.
Вывод
Полученные данные свидетельствуют о том, что соединение А не обладает существенными защитными свойствами в модели шумовой травмы.
Отчеты о рецензировании
Фон
Глюкокортикоиды в настоящее время служат единственным клинически доступным средством для лечения различных отологических расстройств. Однако они часто вызывают серьезные побочные эффекты, включая диабет, кратковременную дисрегуляцию уровня глюкозы в крови, остеопороз и задержку роста (1-4). Чтобы свести к минимуму эти риски, в настоящее время обычным является применение стероидов локально (например, внутритипанически) для терапии, но все еще существует клиническая потребность в более эффективных и специфических соединениях и лучшем понимании того, как глюкокортикоиды оказывают свои отопротективные эффекты (5, 6).
Два процесса были идентифицированы как особенно значимые в глюкокортикоидной активности: трансрепрессия и трансактивация. Транспрессия провоспалительных факторов транскрипции (например, NF-KB) запускается, когда цитозольные глюкокортикоидные рецепторы (GR) связывают активный агент, а комплекс лиганд-рецептор транслоцируется в ядро (7). Трансактивация суммирует димеризацию GR и последующее связывание со специфическими последовательностями ДНК (элемент ответа на глюкокортикоид или GRE), что в первую очередь вызывает побочные эффекты, связанные с использованием глюкокортикоидов. Селективные модуляторы глюкокортикоидных рецепторов (SEGRMs - до недавнего времени единообразно именуемые SEGRA / -агонистами) были разработаны для противодействия воспалению путем вмешательства в путь транскрипционного фактора (рецепторные мономеры) без влияния на GRE, таким образом уменьшая вероятность нежелательных явлений (хотя эта гипотеза стал спорным в последние годы) (8).
Обширные исследования in vitro и in vivo показали, что первый коммерчески доступный SEGRM, Соединение A (CpdA), способствует трансрепрессии по сравнению с трансактивацией (8). Противовоспалительные эффекты CpdA были продемонстрированы на моделях артрита, астмы и воспалительных заболеваний кишечника и нейровоспалительных заболеваний, при этом несколько исследований показали снижение профиля побочных эффектов (9-16). Тем не менее, эффективность CpdA еще не была проверена на слух. Напротив, многие исследовательские группы применяли синтетические глюкокортикоиды (например, метилпреднизолон или дексаметазон) к уху как на животных, так и на человеческих моделях, чтобы оценить их влияние на временные сдвиги порогов (TTS: <24 ч) и / или постоянные сдвиги порогов (PTS: Через 2-3 недели), хотя и с различной степенью успеха (17-20).
В первом, насколько нам известно, исследовании, посвященном тестированию SEGRM в отологии, наша группа продемонстрировала, что внутримышечная доставка CpdA приводила к потере слуха на модели морской свинки, тогда как системное применение не приводило к пороговым сдвигам, что предполагает стабилизирующий эффект плазмы. связывание с белками (21, 22).
Текущее исследование было разработано, чтобы определить, может ли CpdA служить системной альтернативой с потенциально более благоприятным профилем побочных эффектов, то есть агентом, вызывающим меньшее количество вышеупомянутых осложнений.
методы
Все процедуры на животных были одобрены местным Институциональным комитетом по уходу и использованию животных и Федеральным министерством науки и исследований Австрии (BMWF-66.009 / 0165-II / 3b / 2013). Уход за грызунами и их обработка соответствовали рекомендациям Федерации европейских ассоциаций лабораторных животных.
40 взрослых пигментированных морских свинок были разделены на 4 когорты по 10 животных в каждой, с учетом пола (М = 5; F = 5 в каждой когорте) и веса (все животные массой ≥ 300 г, статистически значимой разницы между когортами не было). Грызуны получали внутрибрюшинную инъекцию одного из четырех экспериментальных методов лечения один раз в день в течение десяти дней подряд: CpdA (1 мг / кг); CpdA (3 мг / кг); дексаметазон (1 мг / кг) в качестве золотого стандарта; или соответствующее количество воды (отрицательный контроль) (см. рис. 1а для экспериментальной шкалы времени). Безопасная дозировка была определена и описана в вышеупомянутом исследовании (после обзора других испытаний, включавших системное применение препарата) (15, 22, 23).
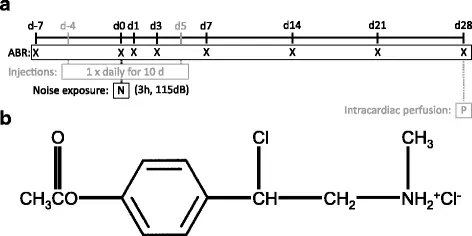
Экспериментальная хронология. Сокращения: d = день / с, ABR = слуховой отклик ствола мозга, h = часы, дБ = децибелы. б) Химическая структура соединения А
Изображение в полном размере
Соединение А
Соединение А или 2- (4-ацетоксифенил) -2-хлор-N-метил-этил-аммонийхлорид (Enzo Life Sciences, Lausen, Швейцария; химическая структура, показанная на фиг. 1b) разбавляли в воде для инъекций. Аликвоты замораживали при -80 ° С и оттаивали непосредственно перед введением.
обезболивание
Общая анестезия для регистрации слухового ответа ствола мозга (ABR) и воздействия шума была индуцирована медетомидином (0, 3 мг / кг), мидазоламом (1 мг / кг), фентанилом (0, 03 мг / кг) и кетамином (10 мг / кг). Бустерную инъекцию половинной дозы вводили через 1, 5 часа при воздействии шума. Температуру тела поддерживали на уровне 38 ° С с помощью электрогрелки. Анестезия была частично антагонизирована с применением атипамезола (1 мг / кг) к концу каждой процедуры.
Акустическая травма
После пяти инъекций экспериментальной обработки (для достижения достаточного уровня лекарственного средства в обоих ушах) морских свинок помещали на вращающуюся пластину в звукоизолирующей камере mac-2 (Industrial Acoustics Company, Winchester, UK) и подвергали воздействию 8-16 кГц. шум октавной полосы при 115 дБ в течение трех часов. Звук подавался через пьезоэлектрический рожок PH 8 (Conrad Electronic, Hirschau, Германия), расположенный на расстоянии 5 см от ушных раковин животных, и усиливался с помощью широкополосного усилителя AMP75 (изготовлен по заказу Томаса Вульфа, Университет Гёте во Франкфурте, Франкфурт-на-Майне). Германия). Калибровка шума до целевого уровня звукового давления была выполнена перед сеансами воздействия.
Слуховые ответы ствола мозга
Пороговые значения ABR измерялись в звукоизолирующей камере, описанной выше, оснащенной динамиком DT-48 (Beyerdynamic, Heilbronn, Германия) и микрофоном K2 (Sennheiser, Wedemark-Wennebostel, Германия). Ухо, не получающее акустической стимуляции, было подключено с помощью Ohropax classic (Ohropax, Wehrheim, Германия), а специальная установка (Otoconsult, Frankfurt am Main, Germany) позволила оценить слуховой потенциал (22). Слуховые стимулы включали щелчки и тональные импульсы (длительность 3 мс, подъем / спад 1 мс, частота 1-32 кГц, один шаг на октаву). Для получения пороговых значений щелчков звуковое давление увеличивалось с шагом 2 дБ, тогда как для тональных импульсов использовались шаги с шагом 5 дБ (≤100 дБ). Сигналы, вызываемые щелчками и тональными сигналами, регистрировались с частотой захвата выборки 50 кГц, усиливались (80 дБ), подвергались полосовой фильтрации (диапазон 10 Гц - 10 кГц) и усреднялись по 512 щелчкам и 256 тональным импульсам соответственно. Вызванные стимулом потенциалы регистрировали за неделю до (до выставки, исходный уровень) и сразу после воздействия (после выставки), а также в дни 1, 3, 7, 14, 21 и 28. Пороговые значения для слуха были затем независимыми. проанализированы двумя исследователями (LDL & CZ) и были усреднены между исследователями и через уши. Никакой ответ не был оценен как «максимальный протестированный уровень +5 дБ».
гистология
Животных подвергали транскардиальной перфузии 4% параформальдегидом после аудиометрии на 28-й день. Улитки впоследствии вырезали и фиксировали в течение, по меньшей мере, 48 часов и случайным образом распределяли по двум группам для оценки по всему органу Корти или гистологической оценки соответственно.
Для гистологической оценки образцы сначала промывали дистиллированной водой и декальцинировали в 8% этилендиаминтетрауксусной кислоте (Sigma-Aldrich, Вена, Австрия), а затем помещали в парафин для секционирования. Пять срезов толщиной 4 мкм разрезали каждые 100 мкм до средней модиолярной плоскости; остальная часть улитки была последовательно разделена, чтобы включать структуры, такие как мембрана круглого окна. Улитковые срезы затем окрашивали гематоксилин-эозином и оценивали под световым микроскопом. Ослепленный лечением гистопатолог (HS) оценивал барабанную перепонку, стенку барабанной перепонки и слизистую оболочку, мембрану с круглым окном и косточки для изменений, вызванных воздействием. Кроме того, спиральная связка, stria vascularis и спиральные ганглиозные нейроны (SGNs) были оценены на предмет ядерной гиперконденсации фиброцитов и пигментации, интактности и плотности в каждом из 7 срезов (через 3, 5 полуоборота) канала Розенталя (RC). соответственно в трех срединно-полярных срезах, разделенных на 25 мкм. Ядерные профили SGN в каждой из 7 секций RC (измеренные в мм 2) были подсчитаны с использованием программного обеспечения Ellipse3D (ViDiTo, Кошице, Словакия). Плотность SGN указывается как средняя плотность по трем срединно-полярным участкам. Из-за соответствующей плоскости сечения четвертый средний и апикальный витки (см. Wrzeszcz et al., Для номенклатуры) не всегда можно было проанализировать отдельно и поэтому были исключены из статистического анализа (24).
Цельные органы Organ Corti готовили путем удаления отической капсулы и окрашивания ткани изотиоцианатом фаллоидин-тетраметилродамина B (0, 3 мг / мл PBS, Sigma-Aldrich, Вена, Австрия) и тригидрата тригидрохлорида Hoechst 33342 (0, 05 мг / мл PBS)., Life Technologies, Карлсбад, Калифорния, США) в течение 30 мин при комнатной температуре. Повороты улитки были по отдельности встроены во Fluorsave (Calbiochem, Darmstadt, Germany) и наблюдались слепым исследователем (EE) под конфокальным микроскопом для количественного определения процента интактных волосковых клеток (HC) в трех случайно выбранных срезах по 200 мкм каждого поворот (25).
Статистика
Данные были проанализированы с использованием R 3.1.1 (R Foundation для статистических вычислений, Вена, Австрия) и представлены в виде средних значений. Столбики ошибок отражают стандартную ошибку среднего. Был выполнен двусторонний дисперсионный анализ (ANOVA) с применением коррекции HSD Тьюки для множественных сравнений. Для гистологических данных анализ непредвиденных обстоятельств проводился с расширением Фримена-Халтона теста точной вероятности Фишера (26). Значения P менее 0, 05 считались статистически значимыми.
Результаты
Соединение А не предотвращает сдвиг порога после воздействия шума
Сдвиги пороговых значений кликов не были значимо различны между группами - пороги варьировались от -18, 2 дБ ± 5, 3 дБ (CpdA 3 мг / кг; AVG ± SD) до -19, 8 дБ ± 3, 5 дБ (CpdA 1 мг / кг) сразу после воздействия -9, 0 дБ ± 5, 3 дБ (CpdA 3 мг / кг) и -11, 5 дБ ± 5, 4 дБ (CpdA 1 мг / кг) на 28-й день (см. рис. 2).
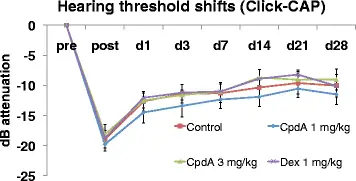
Click-ABR пороги. Результаты для морских свинок в течение 4 недель после воздействия шума, обработанные системным применением воды для инъекций (контроль, квадрат), CpdA 1 мг / кг (алмаз), CpdA 3 мг / кг (треугольник) и дексаметазона 1 мг / кг. (Икс). Столбики ошибок представляют стандартную ошибку среднего. Сокращения: пред = предэкспозиция, пост = постэкспозиция, д = день, дБ = децибел
Изображение в полном размере
Пороговые сдвиги в чистых тонах были более заметными. Как и ожидалось, за шумовым воздействием сразу же последовали сдвиги порогов, характерные для высоких частот (рис. 3, 8-32 кГц, «пост»), но пороги на более низких частотах оставались относительно стабильными (рис. 3, 1-4 кГц, «пост»).”, Максимальный сдвиг 10, 4 дБ ± 5, 9 дБ в контрольной группе при 4 кГц). ANOVA, сравнивая пороги между группами и во времени, не выявило существенных различий в порогах между животными, которые получили отрицательный контроль, по сравнению с любой из доз CpdA. Удивительно, но хотя в группе дексаметазона действительно были более высокие пороги слуха, чем в других группах лечения на некоторых частотах сразу после воздействия шума (например, рис. 3, 16 кГц, «после»), эта тенденция не была статистически значимой. Спонтанное выздоровление (показатель TTS) наблюдалось во всех группах в определенной степени, но повреждение сохранялось на 28-й день (показатель PTS).
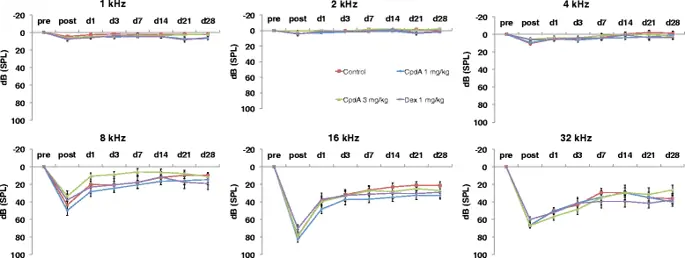
Пороги чистого тона. Результаты для морских свинок в течение 4 недель после воздействия шума, обработанные системным применением воды для инъекций (контроль, квадрат), CpdA 1 мг / кг (алмаз), CpdA 3 мг / кг (треугольник) и дексаметазона 1 мг / кг. (Икс). Столбики ошибок представляют стандартную ошибку среднего. Сокращения: пред = предэкспозиция, пост = постэкспозиция, д = день, дБ = децибел
Изображение в полном размере
Воздействие шума вызывает минимальную потерю волосковых клеток во всех группах
Наружные и внутренние HC, проанализированные из базального, второго и третьего витка и апикального улиткового среза, показали лишь незначительную потерю HC без статистической значимости в группах лечения (Таблица 1; Рис. 4), что подтверждает вывод о минимальном смещении порогов слышимости.
Таблица 1 Количество внутренних и наружных волосковых клеток (% ± стандартное отклонение)
Таблица в натуральную величину

Конфокальная визуализация у контрольного животного (вода для инъекций) через четыре недели после воздействия шума. Потеря наружных волосковых клеток в базальной области отмечена стрелками. Сокращения: Hoechst = Hoechst 33342 тригидрат тригидрохлорида, DIC = дифференциальный интерференционный контраст, IHC / OHC = внутренние / наружные волосковые клетки
Изображение в полном размере
Спиральные ганглиозные нейроны не показывают групповых различий
Целостность нейронных спиральных ганглиев также была определена количественно (количество SGN на мм 2 на сечение RC), но анализы не выявили статистически значимых различий между группами лечения (контроль: M = 1250 ± 160; CpdA 1 мг / кг: M = 1360 ± 76; CpdA 3 мг / кг: М = 1250 ± 130; дексаметазон: М = 1270 ± 90). Суб-анализы были выполнены, но не выявили каких-либо частотных различий между группами.
Гистологическая оценка подтверждает результаты ABR
Оценка среднего уха выявила небольшие области тканевой реакции на воздействие шума (остеонеогенез, фиброз и метаплазия эпителиальной оболочки буллы) у нескольких животных, но эти изменения не могли быть связаны с определенным лечением.
Отделение Stria vascularis, спиральная пигментация связок и фиброциты типа III, демонстрирующие ядерную гиперконденсацию, были детально оценены. Качественная оценка stria vascularis выявила промежуточное и маргинальное отслоение клеток от базально-клеточного слоя у 40% контролей, 20% CpdA 1 мг / кг и 86% CpdA 3 мг / кг животных; однако ни у одного из животных в группе дексаметазона не наблюдалось отслоения stria vascularis (таблица 2, рис. 5, точный критерий Фишера: р = 0, 02).
Таблица 2 Гистологическая оценка внутренних ушей (%, * р <0, 05)
Таблица в натуральную величину
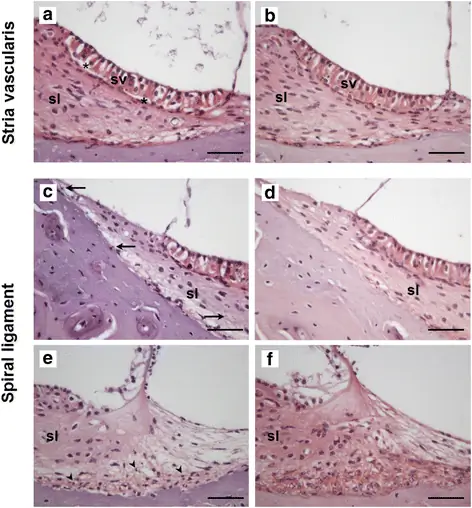
Репрезентативные срезы улитки животных в разных экспериментальных группах. CpdA 3 мг / кг (a, c, e), контроль (b, d) или дексаметазон в качестве действующего золотого стандарта (f). Гистопатология сосудистой стенки (a, b) и спиральной связки (c - f) изображена. Отслоение stria vascularis было отмечено у высокой доли животных, получавших CpdA. Звездочками (*) отмечен разрыв между краевыми / промежуточными клетками и базальными клетками stria vascularis (sv), граничащими со спиральной связкой (sl). b Стрия сосудистая у большинства контрольных и обработанных дексаметазоном животных не обнаружила каких-либо признаков отслоения. c, d Накопление пигмента в спиральной связке (стрелки, указывающие на гранулы пигмента) наблюдалось у относительно большего числа животных, получавших CpdA (c), по сравнению с контрольными животными или животными, получавшими дексаметазон (d). е, f Ядра фиброцитов типа III в спиральной связке показывают высокую степень конденсации (е, наконечники стрел), в то время как у контрольных животных или животных, обработанных дексаметазоном (f), в основном не проявляются. Шкала баров = 50 мкм
Изображение в полном размере
Группа дексаметазона была также единственной группой, у которой не было выявлено признаков пигментации спиральной связки (контроль: 60% содержало пигмент; CpdA 1 мг / кг: 40%; CpdA 3 мг / кг: 86%; дексаметазон: 0%) (таблица 2) Рис. 5, точный критерий Фишера: р = 0, 04).
Наконец, число фиброцитов типа III, демонстрирующих ядерную гиперконденсацию, варьировалось между экспериментальными группами. Несколько пикнотических ядер фиброцитов типа III были обнаружены во втором и третьем средних витках контрольной и улитки, подвергшейся воздействию дексаметазона (40 и 50% соответственно); однако 80% CpdA 1 мг / кг животных и 71% CpdA 3 мг / кг демонстрировали ядра конденсированных клеток в этих областях. У некоторых также появились признаки гиперконденсации в первом среднем повороте (20% в группе 1 мг / кг и 29% в группе 3 мг / кг) (таблица 2, рис. 5, точный критерий Фишера: p = 0, 51 и 0, 44 соответственно).
обсуждение
Здесь мы представляем первую оценку SEGRM как альтернативы глюкокортикоидам для сохранения слуха после шумовой травмы. Хотя эксперименты, проводимые без непосредственного изучения молекулярных путей, могут дать представление о механизме действия препаратов последнего класса, которые, несмотря на их широкое клиническое применение, остаются недостаточно изученными.
В нашем исследовании CpdA (SEGRM) сравнивали с дексаметазоном (положительный контроль) и водой (отрицательный контроль) по его способности сохранять слух после чрезмерного воздействия шума. Результаты показывают, что ни одна из доз CpdA (1 мг / кг против 3 мг / кг) не обеспечивала физиологическую или анатомическую защиту, которая значительно отличалась от той, которую предлагал отрицательный контроль (вода). Однако CpdA и дексаметазон значительно различались по своим способностям сохранять улитковую анатомию после воздействия шума; в частности, в то время как у животных, получавших CpdA, наблюдалась отслоение stria vascularis, у животных, получавших дексаметазон, полоса оставалась нетронутой. Хорошо известно, что акустическая чрезмерная стимуляция может спровоцировать отслоение стрии, и хотя точные механизмы, приводящие к этому, неясны, исследования, изучающие на животных моделях возрастной тугоухости, предложили накопление апоптотических клеток в базальном слое стрии в качестве объяснения (27, 28), Поскольку дегенерация предсердий играет важную роль в возрастной потере слуха у животных и людей, возможно, что долгосрочные сдвиги порогов ABR наблюдались бы после нашего периода наблюдения в 4 недели (29-32).
В дополнение к оценке влияния типа лечения на целостность stria vascularis, это исследование также исследовало состояние фиброцитов в различных поворотах улитки. Эти клетки существуют во многих формах во внутреннем ухе и первоначально были классифицированы на четыре типа в зависимости от местоположения, ориентации, иммуноокрашивания и наличия связанных с транспортом ферментов (пятый тип был добавлен спустя несколько лет) (33, 34). Фиброциты типа III расположены по окружности рядом с костью в нижней области спиральной связки и вместе с веретенообразными фиброцитами типа IV (расположенными сбоку от базилярной мембраны) служат для защиты улитки от механических воздействий, вызванных акустическими раздражителями (33, 35). Клеточная конденсация и пикнотические ядра являются ранними признаками апоптоза и были описаны в фиброцитах спиральной связки после чрезмерного воздействия шума на мышиной модели (36). Дегенерация фиброцитов в спиральной связке была признана основным аспектом возрастной кохлеарной дегенерации. Эта патология предшествует потере HC и / или SGN и потенциально могла привести к потере слуха после окончания периода наблюдения (37, 38).
Вопреки ожиданиям, защитный эффект дексаметазона был в лучшем случае минимальным; Кроме того, потеря HC во всех исследовательских группах была низкой. Есть несколько возможных объяснений этих результатов.
Ван и соавт. использовали почти идентичную экспериментальную парадигму в своем исследовании, анализируя влияние дексаметазона на кохлеарную экспрессию Hes1 (39). После внутрибрюшинного введения лекарственного средства в течение 5 дней подряд морских свинок подвергали воздействию шума октавной полосы 8-16 кГц при 115 дБ в течение трех часов, что приводило к сдвигу порога приблизительно на 30-35 дБ (контроль) или на 10-15 дБ (дексаметазон) в диапазоне частот 2-8 кГц через 24 ч (более высокие частоты не оценивались). Они сообщили о более 30% HC, отсутствующих в базальном повороте в контроле, в то время как животные, получавшие дексаметазон, показали 5% потери HC в том же регионе. Тем не менее, было высказано предположение, что пигментированные морские свинки (как используется в нашем исследовании) менее восприимчивы к шуму, чем альбинос (использованный в статье Wang et al.), Возможно, из-за различных распределений глутатион-S-трансферазы и глутатионпероксидазы в stria vascularis у этих грызунов (40-42). Хотя другие результаты (преимущественно у мышей) привели к спорным дискуссиям о степени защиты от шума, возникающего в результате пигментации, было установлено, что пигмент играет важную роль в слухе не только у грызунов, но и у людей (43-45).
В свете этой теории гистологические результаты особенно интересны: отсутствие пигментации спиральной связки в группе дексаметазона могло потенциально сделать этих животных более восприимчивыми к шумовой травме.
Еще один фактор, способствующий несоответствию между нашими результатами и результатами, описанными в Wang et al. исследование показало, что анестетик дексмедетомидин (S-энантиомер медетомидина - используемый в нашем исследовании) защищает от потери слуха, вызванной шумом (46, 47). В целом, результаты Wang et al. Были сильными по сравнению с результатами нескольких других исследований, которые продемонстрировали лишь умеренный защитный эффект (то есть, немного более выраженный, чем у настоящих результатов) глюкокортикоидов после воздействия шума у морских свинок (48, 49).
Неясно, приведет ли использование более стабильного SEGRM, чем CpdA, в модели травмы шума к аналогичным результатам, поскольку известно, что CpdA генерирует алкилирующий проапоптотический метаболит N-метил-2- (4-ацетоксифенил) азиридин в буферных растворах. и - как ранее продемонстрировала наша исследовательская группа - вызывает потерю слуха при интимпимпантическом применении (11, 22). На основании имеющихся гистологических данных, которые предполагают увеличение повреждения у животных, получавших более высокую дозу CpdA (таблица 2), вероятно, что другие фармакологические кандидаты являются более клинически перспективными в отношении их способности оказывать отопротективные эффекты.
Эти эксперименты являются первыми испытаниями нового класса лекарств в поисках альтернатив глюкокортикоидам в отологии. В то время как результаты текущего испытания были отрицательными (ожидаемые из-за лабильности CpdA и узкого терапевтического диапазона), выводы указывают на важную роль в димеризации глюкокортикоидных рецепторов и, будем надеяться, помогут другим исследователям расширить отологический армаментарий (8, 11).
Поскольку лиганд-связывающий домен GR сходен с таковым у рецептора минералокортикоидов (MR; 58% идентичности, 76% положительных), с ним могут связываться как дексаметазон, так и CpdA (хотя последний с более низким сродством) (50, 51). Учитывая растущее количество литературы, демонстрирующей основные функции MR во внутреннем ухе, путь MR может быть релевантным для результатов нашего исследования (предполагая, что димеризация GR и / или активация MR может играть более важную роль, чем трансрепрессия в биологических процессах во внутреннем ухе) (52-54).
Вывод
Хотя SEGRM CpdA не выявил существенных защитных способностей при тестировании на модели индуцированной шумом потери слуха у морских свинок, для определения целесообразности трансактивации необходим анализ большего числа кандидатов в этот класс препаратов - потенциально с более стабильной молекулярной структурой. возможно вместе с МР эффектами) важнее, чем трансрепрессия в функции глюкокортикоидов во внутреннем ухе. В дополнение к этому механистическому пониманию, которое послужит руководством для будущих направлений открытия отопротективных препаратов, такие исследования могут стать отправной точкой для возможного клинического применения аналогов глюкокортикоидов с более благоприятным профилем побочных эффектов для терапии внутреннего уха.
Сокращения
- ANOVAs:
- дисперсионный анализ
- CPDA:
- соединение А
- GR:
- глюкокортикоидный рецептор
- GRE:
- глюкокортикоидный ответный элемент
- HC:
- волосяная клетка
- Г-Н:
- минералокортикоидный рецептор
- PTS:
- постоянное пороговое смещение
- RC:
- Канал Розенталя
- SEGRM:
- селективный модулятор глюкокортикоидных рецепторов
- SGN:
- спиральный ганглион нейрон
- TTS:
- временный порог сдвига
